un articol de: Nephi Stella
Rezumat
Receptorii CB1 și CB2 sunt activați de o mulțime de compuși canabinoizi, fie că sunt produși pe cale endogenă, fie că sunt din plante sau sintetici. Acești receptori sunt exprimați de microglie, astrocit și astrocitom și activarea lor reglează diferențierea acestor celule, funcțiile și viabilitatea lor. Studiile recente arată că celulele gliale exprimă, de asemenea, receptori asemănători cu cei pentru canabinoizi și că activarea acestor receptori reglează diferitele funcții ale celulelor și controlează, de asemenea, și viabilitatea celulară. Acest articol sintetizează aceste fapte și arată cum compușii selectivi care țintesc receptorii asemănători cu cei pentru canabinoizi constituie o terapie promițătoare pentru a gestiona neuroinflamația și pentru a eradica astrocitomul malign. Un fapt important este că țintirea selectivă a receptorilor asemănători cu receptorii pentru canabinoizi trebuie să acționeze terapeutic fără să inducă efectele psihotrope tipice și dependența asociată cu folosirea substanței delta9-tetrahidrocanabinol, ingredientul psihotropic principal produs de planta Cannabis sativa.
Cannabis sativa conține peste 60 de fitocanabinoizi, dintre care cel puțin trei sunt bioactivi: delta9-tetrahidrocanabinolul (THC), canabinolul (CBN) și canabidiolul (CBD) (Turner și ceilalți, 1980). THC induce efectele psihotrope prin activarea receptorilor CB1 exprimați de neuroni (Huestis și ceilalți, 2001); dar acest compus modifică, de asemenea, procesele fiziologice esențiale centrale și periferice prin activarea receptorilor CB1 și CB2 exprimați de celulele gliale și de celulele periferice (Howlett și ceilalți, 2002). Există puține raporturi referitoare la efectele CBN și CBD asupra neuronilor și celulelor gliale, dar se cunoaște faptul că acești compuși reduc răspunsurile inflamatorii periferice și presiunea sanguină prin interacțiunea cu CB2 și cu receptorii asemănători celor pentru canabinoizi, exprimați de celulele imunitare și de cele endoteliale vasculare (Costa și ceilalți, 2004; Herring și Kaminski 1999; Járai și ceilalți, 1999; Malfait și ceilalți, 2000; Perez-Reyes și ceilalți, 1973). Astfel, compuși canabinoizi diferiți vor regla diferite procese fiziologice și această împărțire a bioactivității este mediată de tipuri specifice de receptori. În fapt, în ultimii 20 de ani, cercetarea privitoare la canabinoizi s-a focalizat pe înțelegerea mecanismelor moleculare care mediază acțiunea diferiților canabinoizi în cazul diferitelor tipuri de celule, cu scopul de a elabora instrumente farmacologice și genetice care să țintească selectiv receptorii CB1 și CB2, pentru a înțelege mai bine implicarea lor în diferitele funcții fiziopatologice.
Acest articol este împărțit în trei secțiuni. În prima parte, voi prezenta nivelul actual de înțelegere în ceea ce privește farmacologia canabinoizilor în legătură cu receptorii CB1, CB2 și cei asemănători, și voi menționa, de asemenea, căile de transmisie a semnalului, la care se cuplează acești receptori. În partea a doua a articolului, voi prezenta ce se cunoaște despre expresia receptorilor CB1 și CB2 la nivelul microgliei, astrocitului și astrocitomului și cum activarea acestor receptori afectează funcția acestor celule și viabilitatea lor. În partea finală, mă voi focaliza pe mai multe studii fundamentale care au dovedit expresia receptorilor asemănători cu cei pentru canabinoizi la nivelul microgliei, astrocitului și astrocitomului și au arătat cum activarea acestor receptori reglează funcția și viabilitatea acestor celule. Datorită valorii clar terapeutice a țintirii receptorilor asemănători celor pentru canabinoizi, precum și datorită provocării academice în ceea ce privește elucidarea identității moleculare a acestor receptori, precum și a modului lor de acțiune, studiile prezentate în articolul de față constituie baza pentru un capitol foarte interesant de cercetare din biologia celulei gliale.
Farmacologia canabinoizilor în cazul receptorilor identificați molecular
Deși farmacologia și bioactivitatea canabinoizilor a fost studiată pe larg, totuși, multe întrebări fundamentale au rămas fără răspuns. De exemplu, în vreme ce majoritatea bioactivității asociate cu canabinoizii se crede că este mediată de CB1 și CB2, studiile farmacologice aprofundate arată că canabinoizii reglează funcțiile celulelor independet de acești doi receptori identificați molecular (Begg și ceilalți, 2005; Kreitzer și Stella, 2009). Sunt trei moduri posibile de acțiune a canabinoizilor pentru a regla funcționarea celulei, independent de CB1 și CB2: 1) canabinoizii pot regla funcționarea celulei independent de o proteină țintă (de ex. prin schimbarea fluidității membranei celulare) (Howlett și Mukhopadhyay 2000; Maingret și ceilalți 2001; Oz 2006);
2) canabinoizii pot interacționa cu proteinele care nu transmit direct semnalul (de ex. prin inhibarea transportului de dopamină și adenozină) (Carrier și ceilalți 2006; Price și ceilalți 2007) și/sau
3) canabinoizii își pot produce efectele prin alți receptori, dintre care unii au fost deja identificați din punct de vedere molecular, alții rămânând încă orfani. În vreme ce primele două posibilități constituie aspecte interesant de investigat, am ales să-mi focalizez articolul pe cea de-a treia posibilitate: dovada existenței unor noi receptori, non CB1/2, implicați în interacțiunea cu canabinoizii; dar, înainte de a vorbi despre aceasta, m-am gândit că ar fi important să prezint o scurtă trecere în revistă a chimiei și a farmacologiei canabinoizilor.
Cele 5 clase de compuși canabinoizi
Chimia și farmacologia compușilor canabinoizi este bogată, constând dintr-o rețea vastă de agoniști și antagoniști selectivi și non-selectivi CB1 și CB2. În prezent, sunt cunoscute 5 clase de compuși canabinoizi. Prima clasă cuprinde canabinoizii clasici, care sunt derivați triciclici din dibenzopiran, izolați din planta Cannabis sativa (incluzând THC) sau analogi sintetici apropiați, cum ar fi HU-210 (Figura 1a și b). Acești compuși se leagă neselectiv de CB1 și CB2. A doua clasă de compuși constă din canabinoizii non-clasici, care sunt asemănători structural cu canabinoizii clasici, dar care sunt analogi AC-biciclici și ACD-triciclici, lipsindu-le inelul dihidropiran. Prototipul pentru această clasă este CP-55940 (CP), un agonist complet, atât pentru CB1, cât și pentru CB2 (Figura 1c). A treia clasă de compuși este constituită de aminoalchilindoli, compusul prototip fiind WIN55,212-2 (WIN), un agonist complet pentru ambii receptori CB, care are o afinitate de două ori mai mare pentru CB2 decât pentru CB1 (Felder și ceilalți 1995a). Este important de notat că aminoalchilindolii sunt destul de diferiți din punct de vedere structural de compușii canabinoizi clasici și non-clasici, acest fapt fiind relevant atunci când ne referim la receptorii asemănători cu CB, activați de către acești compuși (Figura 1d). Cea de-a patra clasă de liganzi canabinoizi cuprinde derivați ai acidului arahidonic, care sunt liganzii endogeni pentru receptorii canabinoizi și unii receptori asemănători cu CB. Acești canabinoizi endogeni (eCB) includ anandamida (arahidonoiletanolamida, AEA) și 2-arahidonoilglicerol (2-AG), care se comportă ca agoniști parțiali și compleți față de receptorii CB1 și, respectiv, CB2 (Figura 1e). Cea de-a cincea clasă constă din compușii diarilpirazol, incluzând SR141716, care este numit și rimonabant (Figura 1f) (Rinaldi-Carmona și ceilalți 1994).
Acești compuși sunt agoniști inverși pentru receptorii CB și au fost foarte utili când s-a testat implicarea CB1 și CB2 în diferite procese fiziopatologice.
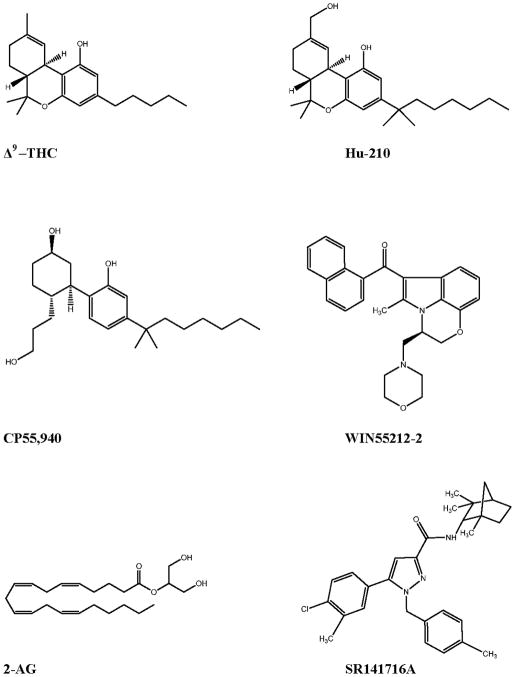
Figura 1 Structura chimică a canabinoizilor prototip
Un aspect important de luat în considerare când se analizează efectele biologice produse de compușii canabinoizi este că ei prezintă în mod tipic afinități nanomolare pentru receptorii CB1 și CB2 și, astfel, analizarea lor la concentrații mai mari de 100nM (adică la concentrații care sunt cu două ordine de mărime peste afinitatea lor) va produce probabil efecte colaterale, incluzând activarea (sau antagonizarea) receptorilor asemănători CB, evidențiați în acest articol.
Receptorii CB1
Receptorii CB1 sunt exprimați la un nivel rdicat în creier cu ajutorul diferitelor clase de neuroni și sunt exprimați la un nivel scăzut de către celulele gliale și de către mai multe tipuri de celule periferice (Howlett și ceilalți 2002; Matsuda și ceilalți 1990; Tsou și ceilalți 1998) (Figura 2). Ei sunt mai abundenți în interneuronii GABAergici decât în neuronii principali glutamatergici (Marsicano și ceilalți 2003; Uchigashima și ceilalți 2007). Totuși, efectele canabinoizilor clasici produse în șoareci, care sunt adesea menționate ca „tetrada” (Howlett și ceilalți 2002) sunt mediate de receptorii CB1 mai puțin abundenți, exprimați de neuronii principali, glutamatergici, după cum este demonstrat într-un studiu elegant pe șoareci care nu au receptori CB1 fie în interneuronii GABAergici, fie în neuronii principali glutamatergici (Monory și ceilalți 2007). Un studiu recent a arătat că deficitele memoriei pe termen lung mediate de THC sunt mediate prin prezența mai abundentă a receptorilor CB1 în cazul neuronilor GABAergici (Puighermanal și ceilalți 2009).
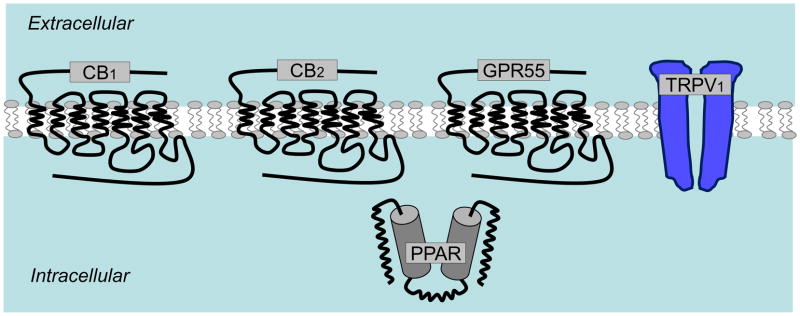
Figura 2 Receptori identificați molecular, activați de canabinoizi
Receptorii CB1 se cuplează cu proteinele Gi/o și modulează activitatea numeroaselor canale ionice și a transmițătorilor secundari (Straiker și Mackie 2006). Se pare că activarea lor acută versus stimularea susținută va modula diferit funcțiile celulelor. De exemplu, activarea acută a receptorilor neuronali CB1, vreme de milisecunde până la secunde, inhibă canalele de calciu de tipul N presinaptice și activează canalele de potasiu corectoare intern, reducând astfel neurotransmisia și controlând excitabilitatea intrinsecă (Henry și Chavkin 1995; Mackie și Hille 1992; Mackie și ceilalți 1995; Marinelli și ceilalți 2009). Pe de altă parte, activarea lor susținută, vreme de minute până la ore întregi, stimulează semnalele intracelulare, cum ar fi ERK, care, la rândul lor, modifică activitatea enzimelor și expresia genelor specifice (de ex. factorul nurotrofic derivat al creierului (BDNF) (Marsicano și ceilalți 2003)). Un fapt important este că mai multe studii au arătat că THC poate funcționa, de asemenea, ca un antagonist pentru receptorii CB1 (dacă aceștia sunt activi endogen), aceasta însemnând că THC ar putea produce unele dintre efectele sale biologice acționând ca un antagonist (Kelley și Thayer 2004).
Receptorii CB2
Receptorii CB2 se cuplează, de asemenea, cu proteinele Gi, dar cel mai probabil nu cu proteinele Go (Glass și Northup 1999; Munro și ceilalți 1993). Ei împărtășesc 44% din identitatea proteinelor cu CB1, dar prezintă un profil farmacologic și un patern de expresie distinct (Felder și ceilalți 1995b; Galiègue și ceilalți 1995). Multe laboratoare au raportat că țesutul cerebral sănătos nu exprimă CB2, cu excepția unei populații mici de neuroni localizați la nivelul trunchiului cerebral și, posibil, și la nivelul cerebelului (Carlisle și ceilalți 2002; Derocq și ceilalți 1995; Galiègue și ceilalți 1995; Munro și ceilalți 1993; Schatz și ceilalți 1997; Skaper și ceilalți 1996; Sugiura și ceilalți 2000; Van Sickle și ceilalți 2005). Mai multe rapoarte au afirmat că aproape toți neuronii din creierul șoarecelui sănătos exprimă receptorii CB2, dar aceste rapoarte nu includ controlul negativ cerut pentru evaluarea specificității prin imunocolorare, în particular imunocolorarea paralelă a acelorași zone din creier, folosind țesut de la șoareci modificați genetic, fără CB2 (Gong și ceilalți 2006; Onaivi și ceilalți 2008; Onaivi și ceilalți 2006). În vreme ce grupul lui Julian Romero a arătat că microglia perivasculară exprimă receptorul CB2 în cazul creierului uman neinflamat (Nunez și ceilalți 2004), este important să subliniem că expresia receptorului CB2 poate fi indusă în mai multe celule imunitare, incluzând microglia (vezi mai jos). Astfel, în condiții neuroinflamatorii, CB2 poate fi sporit în cazul anumitor populații de celule din creier. O altă situație în care nivelurile de CB2 ar putea crește în parenchimul creierului inflamat este ca rezultat al invaziei celulelor imunitare periferice exprimând receptorii CB2, de exemplu celulele periferice T (Maresz și ceilalți 2007).
GPR55
Posibilitatea ca GPR55 să constituie ținta responsabilă pentru unele dintre efectele mediate de canabinoizi, captează din ce în ce mai multă atenție. GPR55 a fost identificat pentru prima dată în 1998 de către cercetători care efectuau căutări omologice ale secvențelor de aminoacizi ale GPCR-urilor cunoscute, folosind BLAST (Basic Local Alignment Search Tool) și bazele de date disponibile public (Sawzdargo și ceilalți 1999). GPR55 mARN este exprimat în cazul creierului sănătos (caudat, putamen, hipocampus, nucleul talamic și creierul mijlociu), splinei, intestinului și țesutului fetal (Sawzdargo și ceilalți 1999). Două patente scoase de companiile farmaceutice care au urmat aceste studii inițiale afirmă că GPR55 reprezintă un nou receptor asemănător cu CB (Drmota și ceilalți 2003; Johns și ceilalți 2007) și, totuși, GPR55 exprimă o omologie a secvenței de numai 13,5% și 14,4% față de CB1 și, respectiv, față de CB2 (Baker et al. 2006). Interesant este că, cele două patente au folosit diferite sisteme de expresie și au obținut profile farmacologice net diferite când a fost vorba de canabinoizi. De exemplu, un patent afirmă că palmitoiletanolamida (PEA), o lipidă strâns legată de AEA, este un agonist cu o afinitate mare care crește legătura [35S]-GTPgammaS în cazul celulelor HEK293 exprimând GPR55 (Ryberg și ceilalți 2007), în vreme ce celălalt patent nu a descoperit nicio activitate a PEA la GPR55.
Mai multe laboratoare au confirmat că unii canabinoizi aplicați la concentrații micromolare activează GPR55, cum s-a arătat monitorizând [Ca2+]i (Henstridge și ceilalți 2009; Lauckner și ceilalți 2008; Oka și ceilalți 2007; Waldeck-Weiermair și ceilalți 2008); dar și aici, profilurile farmacologice raportate de aceste studii au fost adesea diferite. De exemplu, laboratorul lui Ken Mackie a arătat că concentrațiile micromolare scăzute de THC și CP activează în mod clar GPR55 (Lauckner și ceilalți 2008), în vreme ce laboratorul lui Takayuki Sugiura a raportat că acești compuși nu activează GPR55, dar, în schimb, lizofosfatidilinozitolul (LPI) activează GPR55 (Oka și ceilalți 2007). Un studiu recent realizat pe șoareci modificați genetic, fără GPR55, a arătat că CBD acționează ca un antagonist la GPR55, în particular, prin modularea funcției osteoblastelor și osteoclastelor (Whyte și ceilalți 2009). Un aspect care a rămas constant în cazul mai multor laboratoare este că AEA și 2-AG (3-30 microM) nu au niciun efect asupra modulației induse cu GPR55 a [Ca2+]i (Henstridge și ceilalți 2009; Lauckner și ceilalți 2008; Oka și ceilalți 2007). Astfel, în ciuda acestei serii intrigante de studii și patente, nu avem încă o înțelegere clară a acțiunii canabinoizilor în ceea ce privește GPR55, acest fapt lăsând ambiguu profilul farmacologic global al canabinoizilor.
Receptorii activați de canabinoizii atipici
Folosind șoareci cu deficiențe genetice de CB1 și CB2, laboratorul lui George Kunos a identificat un receptor angajat de canabinoizii atipici: activat atât de canabidiolul anormal, cât și de O-1602, și antagonizat de O-1918 (Járai și ceilalți 1999; Offertáler și ceilalți 2003). Acești receptori Gi/o cuplați prin proteine sunt exprimați de celulele endoteliale la nivelul vaselor de sânge, unde cresc producția de cGMP și reglează tensiunea sanguină (Begg și ceilalți 2003a; Offertáler și ceilalți 2003). Profilul farmacologic al acestui receptor este distinct de acela al CB1 și CB2, de vreme ce THC, HU-210 și WIN nu au eficiență în cazul acestui receptor, și unii antagoniști folosiți de obicei la CB1 și CB2 (de ex. AM251, SR144528, AM281 și AM630) nu blochează acest receptor (Begg și ceilalți 2003b; Herradon și ceilalți 2007; Ho și Hiley 2003; McCollum și ceilalți 2007; Wagner și ceilalți 1999). Mecanismele moleculare și căile de transmisie a semnalelor implicate în cazul răspunsului indus cu CBD anormal includ proteinele Gi/o, PI3 Kinază/Akt, canalele de potasiu sensibile la calciu și sintaza NO (Begg și ceilalți 2003b; Ho și Hiley 2003; McCollum și ceilalți 2007). De remarcat că, în vreme ce un raport sugerează că CBD anormal și O-1602 crește legăturile [35S]-GTPgammaS în celulele HEK293T care exprimă GPR55 (Drmota și ceilalți 2003), efectele biologice produse de acești compuși sunt neschimbate în cazul șoarecilor modificați genetic, fără GPR55, comparativ cu șoarecii sălbatici de control, acest fapt sugerând că GPR55 nu este receptorul endotelial care mediază efectele vasodilatatoare ale CBD anormal (Johns și ceilalți 2007).
N-arahidonoil-L-serina (ARA-S) este o lipidă interesantă, încă nestudiată, care ar putea constitui un ligand endogen pentru receptorul sensibil la CBD anormal. Într-adevăr, în vreme ce ARA-S se leagă cu afinitate minimă de CB1, CB2 și TRPV1, ea produce vasodilatație dependentă de endoteliu în cazul arterelor mezenterice izolate de la șobolan, cu un EC50 de 550 nM și acest răspuns este blocat de O-1918 (Milman și ceilalți 2006). În mod remarcabil, CBD anormal inhibă migrația neutrofilelor indusă de fMLP și ARA-S antagonizează acest răspuns (McHugh și ceilalți 2008).
Receptori activați de palmitoiletanolamidă (PEA)
În vreme ce este clar că activarea receptorilor CB1 și CB2 induce analgezie, sunt mai multe dovezi care arată că unele dintre răspunsurile analgezice induse de canabinoizi nu sunt mediate de aceste două tipuri de receptori. Un exemplu remarcabil este în cazul PEA, care nu activează niciunul dintre tipurile de receptori CB1 sau CB2 (Showalter și ceilalți 1996) și, totuși, această lipidă este un analgezic puternic și efectul său este blocat cu ajutorul SR144528, antagonistul lui CB2 (LoVerme și ceilalți 2005). Acest rezultat poate fi interpretat în două feluri: fie 1) atât PEA, cât și SR144528 se leagă de un tip nou de receptor asemănător cu CB (sugerând că SR144528 este un antagonist non-selectiv), fie 2) PEA se leagă de un loc distinct de acela legat de SR144528 și semnalizarea lor ulterioară interacționează.
Receptorii activați de proliferatorul peroxizomului (PPARs)
Sunt trei izotipuri PPAR: alfa, delta și gamma (gamma fiind în continuare divizat în 1, 2, 3). Aceste izotipuri sunt exprimate diferit de variate tipuri de celule, dar, totuși, adesea ele reglează funcții biologice similare (de ex. metabolismul lipidelor și inflamația). În general, PPAR heterodimerizează cu receptorii retinoizi X și cresc rata de transcriere a genelor specifice asupra legăturii ligandului și recrutării cofactorului (Burstein 2005; Michalik și ceilalți 2004). Datorită valorii clar terapeutice a acestor aspecte, este necesară o cercetare intensă pentru a spori înțelegerea asupra modului cum liganzii endogeni activează aceste izotipuri. În aceste experimente s-a arătat că PEA se leagă de PPAR-alfa cu o afinitate relativ mare și reglează expresia genei, sugerând faptul că acest receptor ar putea fi implicat în aceste acțivități biologice ale lipidelor (Lo Verme și ceilalți 2005; Sun și ceilalți 2007). În plus, ștergerea genetică a PPAR-alfa abolește abilitatea PEA de a regla expresia genei, precum și abilitatea ei de a modula răspunsurile inflamatorii independente de CB2 (LoVerme și ceilalți 2005). Aceste rezultate ar trebui să fie luate în considerare în lumina următorului fapt: domeniile PPAR de legătură a liganzilor sunt destul de mari și astfel aceste domenii pot prezenta o legare promiscuă de o zonă cu substanțe chimice înrudite structural (Kliewer și ceilalți 1997). Astfel, 2-AG și AEA (și alte lipide strâns legate de acestea) prezintă activități comparabile în cazul diferitelor izotipuri PPAR (Lenman și Fowler 2007; Rockwell și ceilalți 2006). Chiar și THC, CBD, WIN și CP activează PPAR-gamma și sporesc transcripția dependentă de PPAR-gamma (O’Sullivan și ceilalți 2006a; O’Sullivan și ceilalți 2006b; O’Sullivan și ceilalți 2005). Astfel, în vreme ce PEA ar putea induce o parte din efectul său biologic prin PPAR-alfa, unii fitocanabinoizi, unii canabinoizi sintetici și unele lipide endogene aflate în legătură cu endocanabinoizii ar putea, de asemenea, să medieze o parte din răspunsul lor biologic prin PPAR.
Receptori activați de WIN55212-2(WIN)
Un receptor asemănător cu CB, activat de WIN, a fost identificat pentru prima dată în omogenate de țesut cerebral. În mod specific, WIN (EC50=1,8 microM) și AEA (EC50=3,6 microM) cresc legarea [35S]-GTPgammaS în mostrele de șesut cerebral preparate folosind șoareci CB1 -/-, și acest răspuns este insensibil la rimonabant (Breivogel și ceilalți 2001; Monory și ceilalți 2002). Acest loc de legare este exprimat în trunchiul cerebral, cortex, hipocampus, creierul mijlociu și măduva spinări, fiind absent în cerebel și în ganglia bazală (Breivogel și ceilalți 2001). Nu este sigur dacă acest loc de legare este la nivelul neuronilor și/sau la nivelul celulelor gliale. O complicație în studierea acestui receptor asemănător cu CB este că exprimarea sa variază cu vârsta și cu fondul genetic (Hoffman și ceilalți 2005; Monory și ceilalți 2002). Dovezile electrofiziologice sugerează că acest receptor asemănător cu receptorul CB reglează neurotransmisia în hipocampusul adult, după cum a fost descris pentru prima dată de Hajos și ceilalți, folosind șoareci CB1 -/- (Hajos și ceilalți 2001). În mod specific, WIN a inhibat EPSC (dar nu și IPSC) la sinapsa colaterală schaffer în regiunea hipocampică CA1 la șoareci (Hajos și ceilalți 2001). Acest răspuns a fost, de asemenea, prezent în cazul lamelor cu țesut hipocampic de la șobolan, unde administrarea antagonistului AM251 pentru CB1 și a antagonistului capsazepină pentru receptorul vaniloid a anulat inhibiția mediată de WIN a IPSC, dar nu și a EPSC, indicând că EPSC ar putea fi reglat de un receptor asemănător cu CB, sensibil la AM251, și de capsazepină (Hajos și Freund 2002). Astfel, în vreme ce acest receptor reprezintă o nouă țintă foarte interesantă în reglarea neurotransmisiei, totuși nu avem încă o cunoaștere clară a farmacologiei sale și a modului său de expresie celulară.
Receptorul TRPV1
TRPV1 este un canal cationic neselectiv dependent de ligand, activat de o paletă largă de stimuli, inclusiv de o temperatură mai mare de 43°C, un pH scăzut și de ingredientul activ al ardeiului iute, capsaicina (Zygmunt și ceilalți 1999). Studiile recente au arătat că acest canal ionic este activat de un număr ridicat de canabinoizi, incluzând THC, CBN, WIN, AEA și rimonabant, deși acești compuși sunt activi doar când sunt aplicați în concentrații micromolare (De Petrocellis și ceilalți 2008; Jeske și ceilalți 2006; Patwardhan și ceilalți 2006; Zygmunt și ceilalți 2002). Astfel, este posibil să existe o interacțiune strânsă între receptorul asemănător cu CB, activat de WIN, și TRPV1. Un aspect important care lipsește încă în această zonă specifică a cercetării este de a arăta că canabinoizii activează într-adevăr TRPV1 in vivo și de a arăta cum se traduce acest fapt în senzația dureroasă.
Receptorii CB1 și CB2 la nivelul microgliei
Expresia receptorilor CB1 și CB2 la nivelul microgliei se schimbă în funcție de fenotipul lor și de profilul de activare. În microglia staționară, care poate fi găsită doar la nivelul țesutului cerebral sănătos, nu s-a studiat direct expresia CB1 și CB2, dar putem presupune că aceste celule nu exprimă prea mult din CB1 sau CB2. În mod specific, când sunt colorate secțiunile de țesut cerebral sănătos cu un anticorp CB1, nu se evidențiază celule marcate care să prezinte o morfologie reminescentă a microgliei staționare. În ceea ce privește CB2, în țesutul cerebral sănătos sunt detectabile doar urme vagi de mARN CB2, acest fapt sugerând că microglia staționară nu exprimă deloc CB2 (Carlisle și ceilalți. 2002; Derocq și ceilalți 1995; Galiègue și ceilalți 1995; Griffin și ceilalți 1999; McCoy și ceilalți 1999; Munro și ceilalți 1993; Schatz și ceilalți 1997; Sugiura și ceilalți 2000).
Microglia din culturile primare este activată intrinsec, datorită procedurii implicate în transferarea acestor celule în cultură (Becher și Antel 1996). Mai multe laboratoare au arătat că această microglie activată (preparată din țesut uman, de șobolan sau de șoarece) exprimă o cantitate semnificativă de receptori CB2 (Carlisle și ceilalți 2002; Facchinetti și ceilalți 2003; Klegeris și ceilalți 2003; Walter și ceilalți 2003) și că anumiți factori patogeni și citokine cresc sau reduc această expresie (Carayon și ceilalți 1998; Derocq și ceilalți 2000; Gardner și ceilalți 2002; Lee și ceilalți 2001; Rodríguez și ceilalți 2001; Waksman și ceilalți 1999). Liniile de celule microgliale la rozătoare, incluzând celulele BV-2, care prezintă în mod inerent rate ridicate de proliferare celulară, exprimă, de asemenea, receptorii CB2 (Carrier și ceilalți 2004; Walter și ceilalți 2003).
Receptorii CB2 sunt exprimați de către microglia activată din țesutul cerebral, dar, depinzând de tipul neuropatologiei care îi activează, fenotipul lor variază, la fel ca și prezența și numărul receptorilor CB2 exprimați. Un exemplu remarcabil este în cazul măduvei spinale de șobolan, unde durerea neuropată crește numărul de receptori CB2 la nivelul microgliei, dar durerea inflamatorie cronică nu (Zhang și ceilalți 2003). Un alt studiu demonstrează, de asemenea, creșterea numărului de receptori CB2 la nivelul microgliei in vivo, ca răspuns la o stare inflamatorie (Maresz și ceilalți 2005). Microglia activată din țesutul cerebral al pacienților cu Alzheimer și scleroză multiplă exprimă receptorii CB2, în special atunci când aceste celule sunt asociate cu plăcile care se acumulează în cazul acestor boli (Benito și ceilalți 2003; Yiangou și ceilalți 2006), așa cum se întâmplă cu microglia activată dintr-un model simian de demență SIDA (Benito și ceilalți 2005). Astfel, creșterea numărului de receptori CB2 în cazul microgliei activate poate să aibă loc ca rezultat al unor neuropatologii specifice și al unor răspunsuri neuroinflamatorii și această creștere depinde cel mai probabil de combinația toxinelor, patogenilor, citokinelor și moleculelor întâlnite de aceste celule imunitare și de reglarea expresiei genelor.
Activarea receptorilor CB2 microgliali de către canabinoizi reglează funcțiile lor imunitare. De exemplu, activarea receptorilor CB2 sporește proliferarea și migrația celulelor microgliale, în vreme ce reduce eliberarea de factori negativi, incluzând TNFalfa și radicali liberi (Carrier și ceilalți 2004; Dirikoc și ceilalți 2007; Eljaschewitsch și ceilalți 2006; Ramirez și ceilalți 2005; Walter și ceilalți 2003). Astfel, efectul global al stimulării receptorilor CB2 la nivelul microgliei este că în locurile lezate se vor acumula mai multe microglii „mai puțin dăunătoare”.
Receptorii CB1 sunt exprimați de celulele microgliale în cultură, cel puțin când cultura este preparată din moluscă, șoarece sau șobolan, dar nu când este preparată cu țesut de la om (Carlisle și ceilalți 2002; Facchinetti și ceilalți 2003; Klegeris și ceilalți 2003; Molina-Holgado și ceilalți 2002a; Sinha și ceilalți 1998; Stefano și ceilalți 1996; Waksman și ceilalți 1999; Walter și ceilalți 2003). Este un fapt controversat cum reglează acești receptori funcționarea celulelor microgliale. De exemplu, CP, acționând asupra CB1 crește producția de NO în cazul microgliei de moluscă (Stefano și ceilalți 1996), dar inhibă eliberarea indusă de LPS a NO în cazul microgliei de șobolan (Waksman și ceilalți 1999). Efectul din urmă al CP asupra producției de NO este doar parțial antagonizat de rimonabant aplicat în concentrații micromolare, fapt care pune problema implicării reale a receptorilor CB1 în acest răspuns (Stefano și ceilalți 1996; Waksman și ceilalți 1999).
Pe scurt, mai multe laboratoare au arătat că celulele microgliale exprimă receptorii CB1 și CB2 și că activarea acestor receptori în condițiile de cultură celulară reglează funcțiile imunitare specifice îndeplinite de aceste celule. Întrebarea care rămâne este: Activarea acestor receptori exprimați de microglie in situ afectează neuroinflamația in vivo și, dacă este așa, cum?
Receptorii CB1 la nivelul astrocitelor
Puține studii s-au îndreptat către profilul expresiei și semnificația funcțională a receptorilor CB în astrocite. Astrocitele în culturi preparate din diferite specii pot varia în fenotip și, astfel, astrocitele de la șobolan exprimă în cultură CB1, în vreme ce astrocitele de la șoarece nu exprimă în cultură acești receptori (Antel și Becker 1997; Bouaboula și ceilalți 1995; Sánchez și ceilalți 1998a). Activarea CB1 la nivelul astrocitelor controlează funcțiile lor metabolice: de exemplu, activarea receptorilor CB1 în cazul astrocitelor de șobolan crește rata oxidării glucozei și a ketogenezei, două mecanisme implicate în alimentarea cu energie a creierului (Blázquez și ceilalți 1999; Sánchez și ceilalți 1998b). Activarea receptorilor CB1 de la nivelul astrocitelor temperează abilitatea acestor celule de a produce mediatori inflamatori, incluzând producția de NO indusă de lipopolizaharide și IL-1beta (Blázquez și ceilalți 1999; Molina-Holgado și ceilalți 2002b; Sánchez și ceilalți 1998b; Sheng și ceilalți 2005). Astrocitele in situ exprimă CB1 (Moldrich și Wenger 2000; Rodríguez și ceilalți 2001; Salio și ceilalți 2002) și, astfel, receptorii CB1 de la nivelul astrocitelor și endocanabinoizii mediază unele interacțiuni neuron/astrocite, măsurate în cazul secțiunilor de creier de la șoarecii adulți (Navarrete și Araque 2008).
Luând în considerare abilitatea receptorilor CB1 de la nivelul astrocitelor de a regla metabolismul energetic și de a media interacțiunile neuron-glie, putem specula despre rolul lor fiziopatologic. Majoritatea astrocitelor perivasculare în cazul creierului de șobolan adult exprimă CB1 (dintre care 70% sunt localizați pe plasmalema corpului celular și a proceselor gliale filamentoase) (Rodríguez și ceilalți 2001). Deoarece astrocitele perivasculare sunt localizate pivotant și sunt implicate în alimentarea cu energie de la sânge la neuroni într-o manieră dependentă de activitate (Magistretti 2009), o ipoteză este că receptorii astrocitici CB1 reglează alimentarea cu energie a neuronilor. Astfel, metabolismul energetic al creierului de șobolan crește după expunerea la AEA și THC (Costa și Colleoni 2000). Astfel, nefiind încă pe deplin studiați, receptorii CB1 exprimați de astrocite ar putea fi implicați într-o gamă bogată de funcții reglatoare fundamentale.
Receptorii CB1 și CB2 în cazul astrocitomului
La mijlocul anilor 90, compania farmaceutică Sanofi-Aventis Research a raportat că receptorii CB1 sunt prezenți în diferite linii de celule de gliom la om, precum și în diferite tumori extirpate, cu variate grade de malignitate (Bouaboula și ceilalți 1995; Bouaboula și ceilalți 1996). Astfel, agoniștii canabinoizi au activat ERK și krox-24 în culturile cu liniile de celule de gliom la om, ambele fiind antagonizate de rimonabant aplicat la concentrații nanomolare (Bouaboula și ceilalți 1995). La scurt timp după publicarea acestor rezultate, grupul lui Manuel Guzman a făcut o serie de studii, testând ipoteza conform căreia canabinoizii pot fi agenți antitumorali redutabili în tratamentul astrocitomului. O sub-clonă a liniei de celule de gliom la șobolan C6, anume C6.9, a fost sensibilă la administrarea de THC, dar acest efect toxic nu a fost antagonizat nici de rimonabant, nici de SR144528, ci doar de combinația lor, sugerând că activarea oricărui tip de receptor este suficientă pentru a induce apoptoza în cazul astrocitomului (Galve-Roperh și ceilalți 2000). Autofagia și p8, un mediator al sorții celulei, reglat de stres, constituie elementele principale în apoptoza acestor celule C6, indusă de THC (Carracedo și ceilalți 2006; Salazar și ceilalți 2009). Bazându-se pe aceste rezultate, laboratorul lui Guzman a testat proprietățile antitumorale ale canabinoizilor asupra celulelor C6 injectate stereotactic în creierul de șobolan. La două săptămâni de la injecția celulelor C6 s-au format tumori invazive și animalele netratate nu au supraviețuit mai mult de 3 săptămâni (Galve-Roperh și ceilalți 2000). Administrarea intratumorală fie de THC, fie de WIN a încetinit dezvoltarea tumorilor, crescând timpul mediu de supraviețuire după inoculare (Galve-Roperh și ceilalți 2000). Aceste rezultate au fost aproape spectaculoase: în 25% dintre cazurile tratate cu canabinoizi, gliomul a fost eradicat complet și acești șobolani au supraviețuit după observațiile studiului (Galve-Roperh și ceilalți 2000). În plus, tratamentul cu canabinoizi nu a deteriorat țesutul sănătos din vecinătate. Nu se știe până la momentul de față dacă aceste efecte terapeutice ale THC și WIN sunt mediate cu adevărat de CB1 și/sau CB2. Acesta este un aspect important, deoarece injectarea stereotaxică a canabinoizilor este posibil să provoace concentrații locale ridicate. Astfel, extinzând aceste experimente prin testarea selectivă a agoniștilor CB1 și CB2 (sau administrând concomitent antagoniști selectivi) se va putea determina implicarea acestor tipuri de receptori în cazul acestui efect terapeutic foarte promițător al canabinoizilor.
O problemă controversată în cazul acestor studii este dacă CB2 este exprimat sau nu în țesutul cerebral afectat de tumoră (Bouaboula și ceilalți 1995; Bouaboula și ceilalți 1996; Sánchez și ceilalți 2001). Deși datele farmacologice sugerează că acest tip de țesut nu exprimă receptorii CB2, datele de exprimare corespunzătoare echivalente, obținute cu ajutorul anticorpilor disponibili pe piață au fost mult mai dificil de interpretat. Pentru a corobora descoperirile lor, Guzman și colegii săi au raportat că atât celulele C6, cât și țesuturile afectate de gliom la om exprimă mARN specific receptorilor CB1 și CB2 și proteinele specifice (Sánchez și ceilalți 2001), contrazicând un studiu mai vechi, care afirma că nu s-a găsit nicio urmă de mARN CB2 în cazul liniilor de celule de astrocitom la om și al țesuturilor corespunzătoare (analiză făcută prin RT-PCR) (Bouaboula și ceilalți 1995). Un studiu mai recent a raportat qPCR și analizele imunohistochimice ale biopsiilor făcute în cazul a 37 de astrocitoame la om, de malignitate diferită (Held-Feindt și ceilalți 2006). Pe scurt, sunt mai multe dovezi care susțin valoarea chimioterapeutică a canabinoizilor acționând asupra CB1 și CB2 în astrocitom în cultură și aceste rezultate trebuie încă să fie investigate in vivo.
Microglia exprimă receptori asemănători cu CB
Multe dintre studiile mai vechi care au analizat rolul receptorilor pentru canabinoizi în celulele microgliale în cultură indică că sunt necesare concentrații ridicate de agoniști ai canabinoizilor pentru a afecta funcțiile imunitare ale celulelor microgliale, sugerând că acești compuși nu acționează prin CB1 și CB2, ci, mai degrabă, prin receptorii asemănători cu CB. De exemplu, numai concentrațiile micromolare ale agoniștilor canabinoizi sintetici CP, WIN și HU210 inhibă eliberarea de citokină din microglia șobolanului în cultura primară, și acest răspuns nu este stereoselectiv și nici nu este blocat complet de concentrațiile micromolare de rimonabant (Facchinetti și ceilalți 2003; Puffenbarger și ceilalți 2000). Deoarece asemenea concentrații ridicate de canabinoizi sunt necesare pentru a modula funcțiile celulei microgliale, încă este dificil să interpretăm complet aceste rezultate timpurii, precum și să identificăm tipul de receptor asemănător cu CB, implicat în reglarea eliberării de citokină din microglie, indusă de canabinoizi. Astfel, aceste studii timpurii ar trebui revizuite, de exemplu, folosind microglii cărora le lipsesc receptorii CB1 și CB2 și/sau tratând aceste celule cu compuși cunoscuți pentru faptul că activează și antagonizează diferite tipuri de receptori asemănători cu CB. Receptorii candidați evidenți care ar trebui testați sunt GPR55, PPARgamma și TRPV1 (Bernardo și ceilalți 2005; Kim și ceilalți 2006; Petrova și ceilalți 1999; Pietr și ceilalți 2009). În ceea ce privește GPR55, un studiu recent a arătat că atât microglia de la șoarece în cultură primară, cât și celulele BV-2 exprimă mARN GPR55 și că agonistul său endogen, LPI, activează ERK în aceste celule, demonstrând că acest receptor este într-adevăr funcțional în aceste celule (Pietr și ceilalți 2009). În plus, mARN GPR55 și activarea ERK indusă de LPI sunt reglate diferit de LPS și IFNgamma și această schimbare în expresie este paralelă cu cea a mARN CB2 (Pietr și ceilalți 2009), sugerând că expresia GPR55 și CB2 ar putea fi reglată concomitent de patogenii și citokinele particulare.
Mai multe laboratoare au găsit dovezi farmacologice pentru prezența unor receptori pentru CBD anormal în microglie și în celulele BV-2 (Figura 3). Activarea acestui receptor de către concentrații micromolare de CBD anormal, 2-AG sau arahidonilciclopropilamidă stimulează migrația celulelor BV-2 prin activarea chemotaxisului (un răspuns care depinde de proteinele Gi/o și ERK, și este antagonizat de O-1918 și CBD) (Franklin și Stella 2003; Walter și ceilalți 2003). Activarea celulelor microgliale în cazul culturilor de felii organotipice hipocampice este, de asemenea, reglată de receptorii pentru CBD anormal. Feliile organotipice constituie un model atractiv pentru a studia activarea celulelor microgliale și migrația în prezența neuronilor și astrocitelor, precum și în absența monocitelor și limfocitelor T din sânge. Astfel, folosind acest model, putem să ne întrebăm dacă un compus dat poate modula direct funcționarea celulei microgliale și dacă această modulare afectează excitotoxicitatea independent de celulele imunitare periferice. Într-un studiu inițial, Kreutz și ceilalți au arătat că 3 uM THC și 10 nM 2-AG reduc activarea microgliei asociată cu NMDA în girusul dentat (testată prin colorarea ILB4 și numărând celulele care prezintă o formă amoeboidă) (Kreutz și ceilalți 2007). Antagonistul CB2 AM630 aplicat la 10 uM a blocat parțial răspunsul la THC și, totuși, a sporit răspunsul la 2-AG, ridicând întrebări despre implicarea CB2 în acest răspuns produs de 2-AG. Atunci când s-a testat cum afectează acești compuși excitotoxicitatea (testată prin colorarea cu iodură de propidiu), THC a crescut ușor toxicitatea indusă de NMDA, în vreme ce 2-AG a avut un efect de protecție. Aici, de asemenea, răspunsul THC a fost numai parțial blocat de AM630, în vreme ce răspunsul protector 2-AG a fost insensibil. Una dintre concluziile acestui prim studiu este că nu este nicio corelație între activarea celulelor microgliale și excitotoxicitate în acest model, deoarece THC reduce activarea celulelor microgliale și, totuși, crește toxicitatea. S-ar putea ca monocitele și celulele T care invadează zona să influențeze maniera în care THC modulează microglia și excitotoxicitatea? Această întrebare rămâne deschisă, dar sunt motive să spunem că „da”, deoarece THC poate reduce deteriorarea celulară, temperând direct celulele invadatoare T (Maresz și ceilalți 2007). Într-un studiu ulterior făcut în același laborator, Kreutz și ceilalți s-au focalizat pe efectul 2-AG în cazul feliilor organotipice și au descoperit că acest eCB acționează prin receptori pentru CBD anormal (deoarece 2-AG reduce atât activarea celulelor microgliale, cât și excitotoxicitatea și acest răspuns este blocat de O-1918 și CBD și imitat de CBD anormal) (Kreutz și ceilalți 2009). Astfel, receptorii pentru CBD anormal exprimați de microglie reprezintă o țintă validă pentru a tempera proprietățile negative ale acestor marcofage la nivelul creierului.
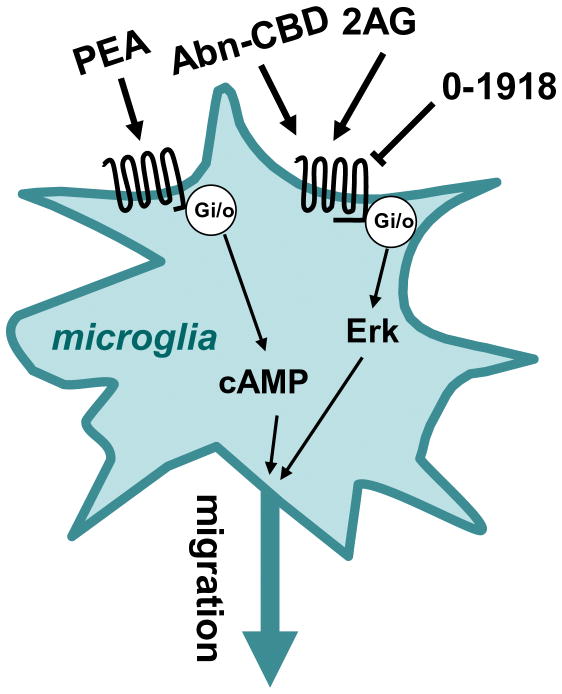
Figura 3 Receptorii asemănători canabinoizilor exprimați de microglie. PEA activează un receptor cuplat cu o proteină Gi/o care inhibă activitatea adenililciclazei, CBD anormal și 2-AG activează, în vreme ce O-1918 antagonizează, un receptor cuplat cu o proteină Gi/o care activează Erk.
S-a arătat că PEA activează un receptor exprimat de celulele BV-2 cu un EC50 de 6nM (Franklin și ceilalți 2003) (Figura 3). Acest receptor se cuplează la Gi/o și abilitatea sa de a reduce concentrațiile intracelulare de cAMP provoacă o creștere a migrației celulare stimulate de AEA, fără afectarea migrației stimulate de 2-AG, proliferarea celulară, eliberarea de NO și fagocitoza particulelor (Franklin și ceilalți 2003). Sporirea cunoașterii asupra faptului cum PEA reglează funcționarea celulelor microgliale ar putea să se dovedească a fi de o importanță terapeutică, deoarece multe răspunsuri neuroinflamatorii, inclusiv cele induse de ischemia cerebrală, sunt asociate cu o acumulare crescută de PEA (Berger și ceilalți 2004; Degn și ceilalți 2007; Franklin și ceilalți 2003; Schäbitz și ceilalți 2002). Astfel, PEA și acțiunea sa asupra receptorilor identificați molecular și/sau orfani exprimați de microglie ar putea fi implicată în orientarea organizată a acestor macrofage către zonele cerebrale care au fost deteriorate.
Împreună, aceste studii sugerează că funcționarea celulei microgliale, și anume, migrarea și abilitatea de a elibera citokine și de a controla asalturile excitotoxice, este reglată de compuși care țintesc receptorii asemănători cu CB. În vreme ce este încă mult de lucru pentru a înțelege detaliile acestor procese, seriile de studii prezentate aici sugerează o nouă paradigmă terapeutică: una care folosește compuși canabinoizi non-psihotropici drept platforme chimice și țintește receptorii asemănători cu CB pentru a tempera deteriorările neuronale induse de excitotoxicitate.
Astrocitele exprimă receptori asemănători cu CB
Prima dovadă pentru prezența receptorilor asemănători cu CB la nivelul astrocitelor provine dintr-un studiu de bază efectuat de Venance (Venance și ceilalți 1995). Practic, acești autori au arătat că AEA (5 uM) și nu CP (1 uM) sau WIN (5 uM), inhibă joncțiunile în cazul culturii de astrocite striatale, un răspuns care nu este antagonizat de rimonabant (0,5 uM) (Figura 4). Interesant este că acest răspuns AEA apare în cazul astrocitelor preparate din striatum de șoarece embrionar, dar nu în astrocitele preparate din cortex de șoarece embrionar, hipocampus și trunchi cerebral, sugerând o exprimare diferențială a acestui receptor particular asemănător cu CB în cazul acestor celule gliale (Venance și ceilalți 1995). Într-un studiu de follow-up, același laborator a măsurat nivelurile de cAMP în astrocitele striatale în cultură și a arătat că AEA inhibă acumularea de cAMP indusă de izoproterenol (IC50s=0,6 uM), un răspuns, de asemenea, insensibil la rimonabant (Sagan și ceilalți 1999). Interesant este că autorii au arătat că astrocitele striatale nu leagă [3H]-rimonabant, și aceste celule nu sunt nici imunocolorate de un anticorp care recunoaște receptorii CB1, fapt care arată că aceste celule particulare în cultură nu exprimă o cantitate semnificativă de receptori CB1 (Sagan și ceilalți 1999). Absența receptorilor funcționali CB1 în astrocitele din cultură fusese sugerată anterior (Jung și ceilalți 1997). Este bine să reținem aici două aspecte. În primul rând, după cum am văzut mai sus, unele laboratoare au detectat receptori CB1 în culturile de astrocite, dar această expresie ar putea depinde de zona din creier din care au fost preparate aceste celule. Deoarece în zilele noastre sunt disponibili șoareci CB1-/-, prezența sau absența receptorilor CB1 funcționali în culturile de astrocite ar putea fi stabilită prin folosirea acestui instrument genetic imparțial. În al doilea rând, rămâne necunoscut faptul dacă inhibarea de către AEA a producției de cAMP mediază abilitatea AEA de a bloca joncțiunile, dar și acest lucru ar putea fi, de asemenea, testat ușor.
Figura 4 Receptorii asemănători cu cei pentru canabinoizi, exprimați de astrocite. Anandamida (AEA) activează un receptor cuplat cu o proteină Gi/o care inhibă activitatea adenililciclazei, WIN reglează producția de oxid nitric (NO) printr-un receptor necunoscut și anandamida închide joncțiunea…
Dovezi în plus pentru prezența receptorilor asemănători cu CB în astrocite provin din studiile care arată că WIN (10 uM) inhibă producția de NO stimulată de IL-1beta, un răspuns parțial blocat de rimonabant (10 uM) și insensibil la SR144528 (10 uM) (Sheng și ceilalți 2005) (Figura 4). AEA stimulează, de asemenea, transportul glicinei în astrocite (EC50=14 uM), un răspuns care nu e imitat de WIN (50 uM) (Pearlman și ceilalți 2003). Astfel, mai multe laboratoare independente au raportat prezența receptorilor asemănători cu CB în cultura de astrocite; dar prezența și semnificația lor funcțională in vivo încă este necesar să fie testată direct, o sarcină care este ușurată de instrumentele genetice și farmacologice care sunt acum disponibile.
Astrocitomul exprimă receptori asemănători cu CB
În 1998, laboratorul lui Manuel Guzman a arătat că 1 uM THC reduce proliferarea celulelor C6 de gliom la șobolan în cultură, neavând niciun efect asupra neuronilor sau astrocitelor din cultura primară (Sánchez și ceilalți1998a). Un fapt important este că administratea concomitentă de rimonabant nu a putut bloca această citotoxicitate indusă de canabinoid (Sánchez și ceilalți 1998a). Acest rezultat poate fi interpretat după cum urmează: fie 1) activarea CB1 nu este implicată sau 2) activarea fie a lui CB1, fie a lui CB2 este insuficientă. Acest efect toxic al THC asupra celulelor C6 implică apoptoza, după cum s-a dedus din fragmentarea ADN-ului și din schimbările în morfologia membranei (Sánchez și ceilalți 1998a). Laboratorul lui Cristopher Fowler a arătat că CP, AEA, 2-AG și JWH-015 (un agonist non-selectiv al CB2) inhibă, de asemenea, proliferarea celulelor C6 (Fowler și ceilalți 2003; Jacobsson și ceilalți 2001). În acest caz, în vreme ce efectele antiproliferative ale AEA și 2-AG sunt blocate de antagoniștii receptorilor canabinoizi, efectele antiproliferative ale CP și JWH-015 nu sunt (Jacobsson și ceilalți 2001). Interesant este că AEA induce apoptoza într-o varietate de linii de celule de gliom la om prin alt mecanism, implicând TRPV1 și plutele lipidice (Bari și ceilalți 2005; Contassot și ceilalți 2004; Jacobsson și ceilalți 2001; Jonsson și ceilalți 2003; Maccarrone și ceilalți 2000). S-a arătat că mulți alți compuși asemănători cu CB induc apoptoza în celulele C6, incluzând analogul eCB stearoiletanolamida, dar ținta moleculară a acestei lipide rămâne necunoscută (Ellert-Miklaszewska și ceilalți 2005; Maccarrone și ceilalți 2002).
Laboratorul Danielei Parolaro a raportat că receptorii asemănători cu CB, angajați de CBD, reglează migrația și viabilitatea celulelor de gliom. CBD aplicat la 3 uM inhibă migrația celulelor de gliom U87 către mediul lor condiționat (Vaccani și ceilalți 2005) (Figura 5). Acest răspuns nu este antagonizat nici de SR141617, nici de SR144528, nici de capsazepină și nu este blocat de pretratamentul cu PTX, arătând clar implicarea CB1, CB2 și TRPV1 în acest răspuns (Vaccani și ceilalți 2005). Nu se știe dacă CBD acționează fie ca un agonist, inhibând migrația, fie ca un antagonist, blocând un chimioatractor prezent în mediul condiționat. CBD aplicat la concentrații mult mai înalte, aici de 25 uM, distruge celulele de gliom U87 și U373 în cultură și acest răspuns nu este antagonizat de SR141617, nici de SR144528 sau de capsazepină, și nu este blocat nici de pretratamentul cu PTX (Massi și ceilalți 2004). Mecanismul molecular care mediază acest efect implică activarea caspazei-3, eliberarea de citocrom c, activarea caspazei-9 și caspazei-8; și producerea de specii reactive de oxigen (Massi și ceilalți 2006). În mod remarcabil, administrarea de CBD intraperitoneal reduce cu 50% creșterea U87 implantată subcutanat în șoarecele nud atimic (Massi și ceilalți 2004).
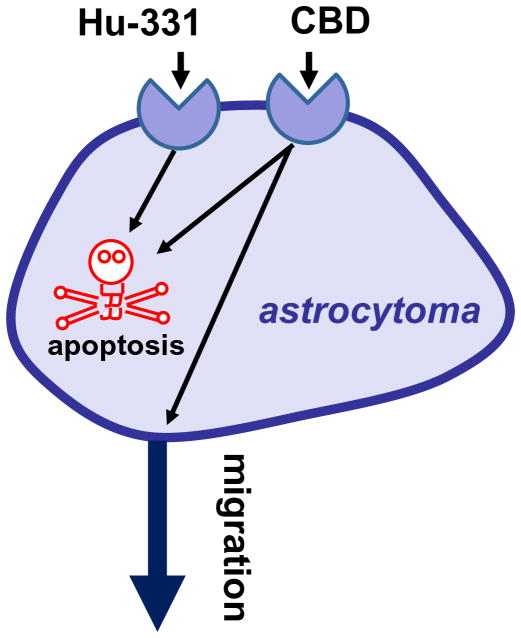
Figura 5 Receptori asemănători cu cei pentru canabinoizi, exprimați de astrocitom. Hu-311 induce apoptoza printr-un receptor necunoscut și CBD induce apoptoza și inhibă migrația celulelor.
Laboratorul lui Raphael Mechoulam a raportat proprietățile antiproliferative ale produșilor oxidați ai unor constituenți ai cannabis-ului (de ex. Hu-331, un produs oxidat al CBD) (Figura 5) (Kogan și ceilalți 2004). Prin tratarea liniei de celule de glioblastom SNB-19 în cultură cu Hu-331 la 25 ug/ml timp de 3 zile au fost distruse mai mult de 90% dintre celule (Kogan și ceilalți 2004). Acest efect nu este mediat de receptorii CB deoarece acești compuși nu leagă acești receptori, ci implică ciclul redox, deteriorarea ADN-ului, inhibarea topoizomerazei, deteriorarea proteinelor și/sau peroxidarea lipidică. Într-adevăr, aceste efecte sunt tipic induse de compuși care conțin grupe de chinină, cum ar fi adriamicina și daunorubicina, ambele fiind folosite clinic pentru tratamentul tumorilor solide de mai bine de 30 de ani (Gewirtz 1999). Grupul lui Mechoulam a arătat în mod convingător că HU-331 acționează cel mai probabil prin inhibarea topoizomerazei II (Kogan și ceilalți 2007).
Recapitulând această subsecțiune, compușii care activează sau antagonizează receptorii asemănători cu CB blochează unele dintre procesele fundamentale implicate în dezvoltarea tumorilor cerebrale, și anume, migrarea și proliferarea lor. În vreme ce țintele moleculare exacte și mecanismele de transmisie a semnalelor care mediază aceste efecte terapeutice încă trebuie să fie descoperite, aceste studii inițiale constituie piatra de început pentru dezvoltarea unor noi agenți chimioterapeutici pe bază de canabinoizi, în cazul cărora lipsesc efectele controversate asociate cu utilizarea și cu abuzul de THC.
Concluzii și posibile direcții viitoare
Studiile prezentate în cadrul acestui articol au fost realizate în ultimele decenii și sugerează următoarea ipoteză testabilă: țintirea farmacologică a receptorilor asemănători cu CB in vivo ar trebui să reducă producția de citokine proinflamatoare de către microglie, să reducă direcționarea acestor macrofage către leziunile cerebrale, precum și să blocheze propagarea și viabilitatea globală a astrocitomului malign. Fiind foarte interesante, aceste rezultate originale este necesar să fie extinse pe modele animale mai elaborate ale neuroinflamației și ale tumorilor creierului. În mod ideal, ar fi indicate studii de follow-up pentru a testa dacă compușii care țintesc receptorii asemănători cu CB sunt ușor de administrat, nu produc efecte secundare semnificative, distrug celulele maligne, cruțându-le pe cele sănătoase, și împiedică acumularea de citokine și celule imunitare proinflamatoare nocive, direcționând către zona lezată celule imunitare reparatoare. În vreme ce aceste așteptări ar putea părea să fie prea ambițioase, datele disponibile deja pentru unii dintre compușii care țintesc receptorii asemănători cu CB sunt destul de promițătoare. Să luăm ca exemplu CBD: acest compus derivat din plante nu induce efectele psihotrope tipice pentru THC la om (Hollister 1973; Perez-Reyes și ceilalți 1973). CBD inhibă migrația astrocitomului și microgliei, astfel încât, tratând pacienții cu acest compus s-ar putea reduce infiltrarea astrocitomului în parenchimul cerebral sănătos și, de asemenea, s-ar putea reduce direcționarea microgliei către masa tumorală. Acest din urmă efect este important să fie obținut deoarece microglia eliberează factori proangiogenetici care favorizează creșterea tumorală (Condeelis și Pollard 2006). Un avantaj în plus pentru CBD este că distruge direct astrocitomul atunci când este aplicat în concentrații ridicate. Luând în considerare folosirea canabinoizilor pentru a trata tumorile maligne, unele laboratoare au încercat să izoleze efectele terapeutice non-psihotrope atribuite activării receptorilor CB2, eliminând proprietățile psihotrope și adictive atribuite activării receptorilor CB1 (Sánchez și ceilalți 2001). Totuși, deoarece sunt necesare cantități extrem de mari de canabinoizi pentru a deveni toxice pentru celulele sănătoase (Iversen 2000), administrarea acestora în concentrații relativ mari, fie pe cale orală, sau chiar direct la nivelul tumorii, nu ar trebui să fie trecută cu vederea. Într-adevăr, injecția stereotactică a compușilor chimioterapeutici direct la nivelul tumorii cerebrale la om constituie o procedură de rutină pentru neurochirurgi și astfel canabinoizii pot fi administrați ușor prin această tehnică (Guzman și ceilalți 2006). Toate studiile prezentate în cadrul acestui articol sugerează că injecția stereotactică cu CBD în concentrații înalte ar putea constitui un regim util pe care neurochirurgii să-l aplice în tratamentul astrocitomului malign și al neuroinflamației excesive/cronice. Un astfel de tratament ar putea genera efecte terapeutice atât direct, prin distrugerea astrocitomului și prin limitarea propagării lui, cât și indirect, prin reducerea acumulării de microglii activate sau de celule imunitare periferice invadatoare.
Faptul că canabinoizii non-psihotropi, acționând prin receptorii asemănători cu CB afectează asemenea procese fundamentale implicate în activarea celulelor microgliale și în propagarea astrocitomului, constituie, în opinia noastră, una dintre cele mai interesante zone de cercetare, în căutarea unor noi agenți chimioterapeutici care să trateze tumorile maligne cerebrale și a unor noi agenți antiinflamatori care să reducă deteriorarea aflată în legătură cu neuroinflamația cronică. În plus, proprietățile curative ale canabinoizilor nu se suprapun peste medicamentele disponibile în prezent și, astfel, tratamentele bazate pe canabinoizi constituie o nouă platformă terapeutică. Totuși, pentru a câștiga un suport public larg, terapiile bazate pe canabinoizi vor trebui să depășească stigmatul abuzului de droguri, prin lipsirea lor de efectele adverse legate de THC, care includ amețeala, dezorientarea, alterarea percepției timpului, tulburările de memorie, anxietatea și posibila dependență. Așadar, este important să sporim cunoașterea farmacologică și moleculară a receptorilor asemănători cu CB, în general, și a celulelor gliale, în special, astfel încât să ne putem folosi de proprietățile lor pentru dobândirea câștigului terapeutic.
Mulțumiri
Lui Susan Fung și William Marrs pentru lecturarea critică a acestui manuscris și lui NIH (DA 14486 și DA 21285) pentru sprijinul de finanțare.






